
上海交通大学医学院附属瑞金医院 陆国平
继《2013 ACC/AHA控制血胆固醇降低成人动脉粥样硬化性心血管疾病(ASCVD)风险指南》正式提出了ASCVD的概念,并取消了血脂达标值之后,一石激起千层浪,血脂领域热点持续升温。如果2014年被称之为血脂“指南年”的话,那么2015年可用血脂的“研究年”来概括。
进一步降低终点事件:依折麦布/辛伐他汀片疗效国际试验(IMPROVE-IT):意义和争议
这是一项在急性冠状动脉综合征(ACS)的高危患者中确立依折麦布/辛伐他汀片与辛伐他汀单药相比的临床获益和安全性的多中心、双盲、随机研究;探索非他汀类药物临床应用的重要研究。2014 年11 月17 日在美国心脏协会(AHA)年会上公布了其主要结果之后,在2015年7月份正式发表于《新英格兰医学杂志》上。
这项研究共纳入18 144例ACS≤10天且病情稳定患者,低密度脂蛋白胆固醇(LDL-C)为50~125 mg/dl,随机接受40 mg辛伐他汀加10 mg依折麦布(治疗组)或40 mg辛伐他汀加安慰剂(对照组)治疗,平均随访7年。主要终点为心血管(CV)死亡、非致死性心肌梗死、因不稳定性心绞痛入院,冠状动脉血管重建术(随机分组后≥30天)或非致死性卒中。
结果显示,随访期末治疗组与对照组的LDL-C分别为53.7 mg/dl vs. 69.5 mg/dl(P<0.001)。7年时,治疗组与对照组主要终点发生率分别为32.7% vs. 34.7%(绝对风险差异为2%;HR=0.936;95%CI:0.89~0.99),两组患者主要终点的相对风险降低6.4%,且两条曲线在>1年时分离(图2左)。
该研究深化了胆固醇理论。对ACS患者而言,即使在很低的LDL-C水平(70 mg/dl),进一步降低LDL-C至53 mg/dl仍能获益,该研究也再次证实降胆固醇是硬道理。他汀基础上加用另一种降LDL-C的药物同样能够减少事件。
尽管IMPROVE-IT研究显示出了辛伐他汀加依折麦布在终点事件上存在获益,然而,2015年12月14日,FDA内分泌及代谢药物咨询专家委员会(EMDAC)通过投票(5票支持10票反对)否定了依折麦布及依折麦布/辛伐他汀用于冠心病二级预防的应用申请。投反对票者认为IMPROVE-IT结果没有表现出足够的获益。而同样作为投反对票的专家也认为基于IMPROVE-IT研究的结论,可以将原说明书适应证中标示的“The effect of ZETIA on cardiovascular morbidity and mortality has not been determined”这样的表述去掉”。因此,反对的专家并不反对IMPROVE-IT研究证实了胆固醇理论以及依折麦布在他汀基础上在ACS人群中降低LDL-C从而带来额外的心血管获益。其次,FDA专家委员会投票是FDA审查新适应证审批的其中一个步骤。FDA在审核新适应证申请时会参考专家委员会年的建议,但根据FDA的指导文件,专家建议不是最终的决定。
关于IMPROVE-IT获益大小,笔者认为:根据基线LDL-C水平从高到低,降低相同幅度的LDL-C,其获益也是从大到小(见图1)。故该研究中依折麦布/辛伐他汀组(LDL-C水平53 mg/dl)较辛伐他汀单药组(LDL-C水平70 mg/dl)LDL-C水平下降了24%, 故其事件降低6.4%的结果令人信服。
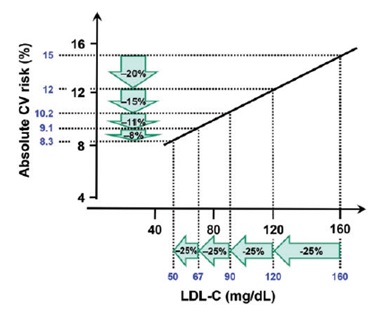
图1. 基线LDL-C水平 vs.心血管相对风险下降
对比该领域的另一项大型研究:PROVE-IT研究,在4162例ACS患者中“头对头”比较了高强度他汀(阿托伐他汀80 mg)和中等强度他汀(普伐他汀40 mg)治疗对心血管预后的影响,平均随访2年。该研究结果显示,主要终点风险降低16%,且两组事件发生率的曲线在3个月就开始分离(见图2右)。
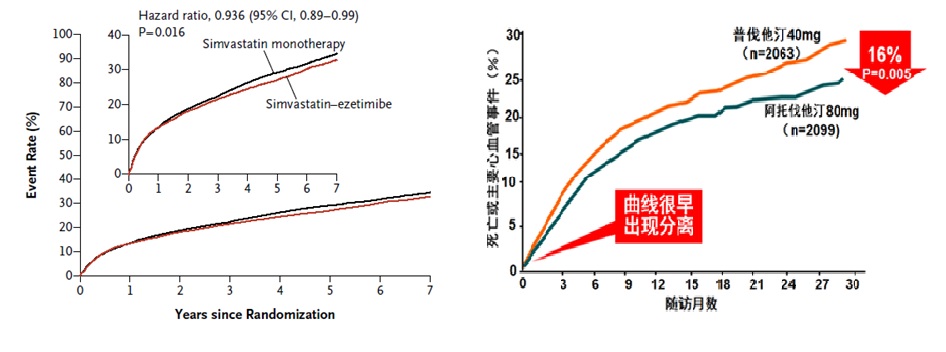
图2. IMPROVE-IT研究(左图)和PROVE-IT研究(右图)的主要结果
基于以上,美国西北大学范伯格医学院Neil J. Stone教授指出,ACS患者高强度他汀疗法仍是主流治疗策略。这也是国外权威指南所推荐的。
笔者认为,循证研究的意义是指导临床实践,个体化治疗,而不是重复昨天的故事。目前已知:将ASCVD患者LDL-C水平降低至<70 mg/dl,甚至50 mg/dl,其事件复发率最低,这才是追根溯源。至于个体患者需用多大的他汀剂量,是否要联合治疗,需根据其基线LDL-C水平。但就目前中国的冠心病患者而言,其基线LDL-C水平不高(<120 mg/dl), 按英国指南,中强度他汀疗法(LDL-C降低30%~40%),也就是既往的他汀标准剂量就可将大部分中国冠心病患者的LDL-C水平降低至<70 mg/dl或<80 mg/dl。
PCSK9抑制剂:已知与未知
从2003年发现前蛋白转化酶枯草溶菌素9(PCSK9)基因,到确定PCSK9在心血管疾病中发挥的作用,PCSK9抑制剂一路高歌着向我们走来。今年更是其喜报频传的一年,两项临床研究结果发表于《新英格兰医学杂志》,并被FDA批准用于家族性高胆固醇或ASCVD患者的二级预防。
作为OSLER 1和2开放标签、非盲法、随机对照研究的扩展,OSLER长期评估研究纳入4465例参与者,评估了evolocumab的长期影响。患者随机分为PCSK9抑制剂联合标准治疗组与标准治疗组(对照组)。中位随访11.1个月,评估血脂水平、安全性,并探索性分析了心血管事件终点。结果显示,与标准治疗相比,evolocumab降低LDL-C幅度为61%,从120 mg/dl降低至48 mg/dl(P<0.001)。然而,神经认知不良事件在evolocumab组更为常见。
另一项随机、双盲、安慰剂对照研究为ODYSSEY LONG TERM研究,纳入2341例冠状动脉疾病高风险、LDL-C≥70 mg/dl且正服用最大耐受剂量他汀类药物的患者,按照2:1比例随机接受alirocumab或安慰剂治疗78周,主要疗效终点为自基线至24周的LDL-C变化。结果显示,从基线到24周LDL-C水平alirocumab组降低了61%;安慰剂组则增加了0.8%。事后分析发现,alirocumab组主要不良心血管事件(MACE)的发生率为1.7%,对照组为3.3%(P=0.02)。
基于以上结果,2005年7月和8月,美国FDA分别批准alirocumab和evolocumab用于家族性高胆固醇或ASCVD患者的二级预防。
然而,梅奥诊所的Rene Rodriguez-Gutierrez 博士等在《美国医学会杂志》发表了《预测PCSK9抑制剂的过度使用》的专家观点,文章指出,我们目前已知,在分别进行了11个月和78周的研究中,PCSK9抑制剂联合他汀能有效降低LDL-C,探索性终点或事后分析表明,这类新药可降低心血管事件。然而,PCSK9抑制剂未知的领域更多,我们仍然不知道长期使用到底是否会产生心血管获益,降低LDL-C水平后是否会产生某些害处(如造成神经认知缺陷),从而抵消了它带来的获益。另外,关于这些药物的远期安全性也是未知领域。毕竟ASCVD预防不是一个仅持续2年的短期工程。两个研究中,PCSK9抑制剂组报告了更多的神经认知事件。这是一个需进一步探讨的问题。有多少患者愿意用一个迟钝的大脑来换数年的寿命呢?因而,有专家认为,对于此类新药,应拒绝冲动,冷静对待。
需指出,迄今为止他汀仍是临床研究证据最为充分的降胆固醇药物,在短时间内其核心地位不会被动摇。无论胆固醇吸收抑制剂还是PCSK9抑制剂,均不会以他汀的终结者的身份出现,只是作为他汀的补充。但这些新型降胆固醇药物的临床应用,为降胆固醇治疗提供了更多选择,也进一步完善了胆固醇理论与血脂异常防治策略。
非诺贝特-他汀类药物联合疗法在致动脉粥样硬化血脂异常患者中的降大血管风险作用的证据综述:专家共识会议报告
2015年末,《动脉粥样硬化杂志》发表了上述的非诺贝特-他汀类药物联合疗法的专家共识。其摘要如下:
2014年11月10日在法国巴黎举行了一次欧洲心血管疾病及血脂专家会议,以讨论血脂特征,尤其是致动脉粥样硬化血脂异常(AD)以及相关的CV风险。本文总结了会议期间提出并讨论的要点,同时还列出了由专家组对这些问题的进一步讨论和商定。与较低的LDL-C水平相比,LDL-C水平的升高通常与较大的CV风险有关,但通常可使用他汀类药物进行管理。尽管如此,即使对于那些使用他汀类药物进行控制且达到了较低的LDL-C水平的患者而言,在一些患者中观察到的异常血脂水平(即,甘油三酯水平升高,伴/不伴水平较低的高密度脂蛋白胆固醇[HDL-C])也可导致存在剩留CV风险。因此,建议测定甘油三酯和HDL-C水平,以对整体CV残余风险进行充分地管理。有利的安全性和临床数据支持他汀类药物与其他降脂药物,如非诺贝特的联用。那些甘油三酯水平升高且HDL-C水平较低的患者最有可能从非诺贝特-他汀类药物联合疗法中获得临床益处。在这些AD患者中,达到非HDL-C目标水平应当是CV风险管理的重点,并且与LDL-C水平相比,认为非HDL-C可更好地测定CV风险。